Puente de hidrógeno
Puente de hidrógeno
Cuando un átomo de hidrógeno se une a átomos con una alta electronegatividad, Como flúor, oxígeno o nitrógeno, se forman enlaces polares en los que los dipolos son fuertes y las interacciones dipolo-dipolo son muy notables. Este tipo de fuerzas intermoleculares de atracción dipolo-dipolo son tan intensas que se les ha dado un nombre especial: puentes de hidrógeno. Estos ocurren cuando se establece una fuerza de atracción entre el átomo de hidrógeno parcialmente positivo de una molécula, y un par de electrones sin compartir del átomo electronegativo (N, O o F) de otra. Los puentes de hidrógeno son un factor importante en la formación y estructura de las moléculas biológicas como las proteínas y el ADN .
La posición del hidrógeno en la tabla periódica indica que debe esperarse que actúe en sus reacciones con dos funciones: una como catión, a través de la pérdida de su electrón del orbitales; y otra como anión por medio de la ganancia de un electrón adquiriendo la estructura electrónica del helio. Esto indica que se puede hallar como un protón (Hl') o como un hidruro (Hl-). En adición a aquellos compuestos electrovalentes, se ha visto que el hidrógeno forma muchos compuestos en los cuales tiene uniones covalentes. Hay muchos compuestos en los que el átomo de hidrógeno existe simultáneamente entre dos átomos, actuando como un puente entre ellos. En esta situación, el átomo de hidrógeno se encuentra envuelto en dos uniones: una covalente, y la segunda conocida como puente de hidrógeno. Las uniones del hidrógeno, generalmente, se hallan con otros átomos que tienen una alta densidad de electrones y, por tanto, un gran valor de electronegatividad, como en los casos del flúor, oxígeno y nitrógeno. Es reconocido que estas uniones tienen carácter electrostático. Los enlaces por puente de hidrógeno tienen una energía de unión de aproximadamente 5 kcal/mol, es decir, son mucho más débiles que las uniones covalentes, cuya energía de unión es de 80 a 100 kcal/mol.
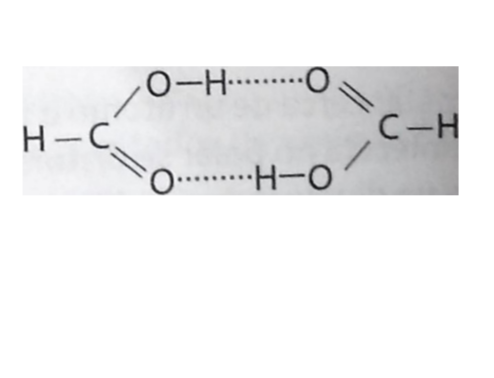
La formación del enlace por puente de hidrógeno contribuye a explicar propiedades anormales observadas en muchos compuestos, como los anómalos puntos de ebullición y pesos moleculares en disoluciones. Por ejemplo, el ácido fórmico (HCOOH) forma un dímero (un agrupamiento de dos moléculas) en disolventes no polares, lo cual resulta en dos veces el peso molecular esperado. Este dímero se forma debido a la presencia de puentes de hidrógeno, de la siguiente manera:
En esta estructura, las líneas punteadas indican la formación de puentes de hidrógeno. Nota que la distancia de enlace del puente de hidrógeno es mucho mayorque la distancia de enlace de la unión covalente oxígeno-hidrógeno, lo que significa que el puente de hidrógeno es más débil que el enlace covalente.
Link para reforzar lo visto:
https://www.sebbm.es/BioROM/contenido/JCorzo/temascompletos/InteraccionesNC/hidrogeno/hidrogeno1.htm
https://youtu.be/ybNJ6ts7fts


Comentarios
Publicar un comentario